El agua es un compuesto químico presente en grandes cantidades en la Tierra, en estado liquido, sólido o gaseoso.
El agua es un compuesto de hidrógeno y oxigeno, su formula química, H2O, indica que cada molécula de agua contiene dos átomos de hidrógeno y uno de oxígeno.
El agua, a pesar de ser un líquido incoloro, inodoro e insípido, es en realidad una sustancia química de reacciones esenciales para la vida.
A la presión atmosférica (760 mm de mercurio), el punto de congelación del agua es de 0° C y su punto de ebullición de 100° C.
El agua es uno de los agentes ionizantes más conocidos. Puesto que todas las sustancias son de alguna manera solubles en agua, se la conoce frecuentemente como el disolvente universal. El agua combina con ciertas sales para formar hidratos, reacciona con los óxidos de los metales formando ácidos y actúa como catalizador en muchas reacciones químicas importantes.
Propiedades bioquímicas
Los seres vivos se han adaptado para utilizar químicamente el agua en dos tipos de reacciones:
• En la fotosíntesis en la que los enzimas utilizan el agua como fuente de átomos de hidrógeno.
• En las reacciones de hidrólisis, en que las enzimas hidrolíticas han explotado la capacidad del agua para romper determinados enlaces hasta degradar los compuestos orgánicos en otros más simples, durante los procesos digestivos.
 |
Propiedades físico-químicas
El agua presenta las siguientes propiedades físico-químicas:
• Acción disolvente.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren la mayoría de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuoso.
• Fuerza de cohesión entre sus moléculas.
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
• Elevada fuerza de adhesión.
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión, de la capilaridad, a la cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
• Gran calor específico.
 |
El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura.
• Elevado calor de vaporización.
A 20° C se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
• Elevada constante dieléctrica.
Por tener moléculas bipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
• Bajo grado de ionización.
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de:
agua molecular (H2O )
protones hidratados (H3O+ ), llamados también iones hidronio o iones hidrógeno, o simplemente H*, e
iones hidroxilo (OH–)
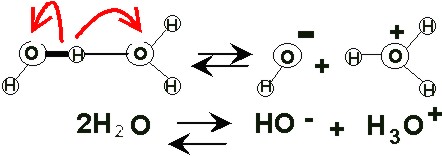 |
De cada 107 moléculas de agua, sólo una se encuentra ionizada.
Esto explica que la concentración de iones hidronio (H+) y de los iones hidroxilo (OH–) sea muy baja. Dados los bajos niveles de H+ y de OH–, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente. (Ver más sobre Agua: Propiedades y funciones)
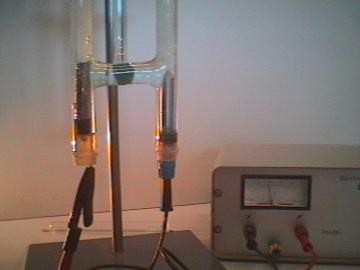 |
Electrólisis del agua
Al pasar electricidad por agua (H2O), se forma gas hidrógeno en el cátodo y oxígeno en el ánodo, como el agua contiene dos átomos de hidrógeno por cada uno de oxígeno, se produce el doble de hidrógeno que oxígeno, se divide así el compuesto en dos partes.
Ver: www2.uni-siegen.de/.../spanish/v21-2.html y Ver, también: Agua oxigenada)
En el siguiente video además de sus propiedades físicas y químicas podrás observar la importancia biológica del agua.
Bibliografía
http://www.profesorenlinea.cl/Quimica/AguaCaracterisFM.htm

No hay comentarios:
Publicar un comentario