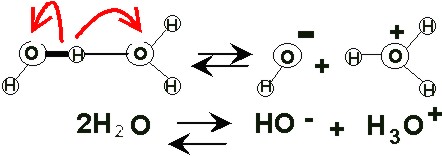
Todo lo que se ha visto, que es la gran importancia que tiene el agua para la vida humana y para la vida en general en el planeta, sirve para comprender lo importante que es cuidarla; no solamente evitando malgastar el agua de que disponemos, sino también evitando que se contamine. (Ver: Hidrósfera)
Si bien es cierto que a escala mundial el agua siempre seguirá existiendo en la misma cantidad, porque el agua es un recurso natural renovable; no es menos cierto que en cada lugar solamente puede obtenerse una cantidad limitada, y, por lo tanto, debe cuidarse.
(Ver: Contaminación del agua)
No hay que olvidar que, precisamente por ser un recurso renovable, el agua deberá utilizarse una y otra vez; por lo cual hay que preocuparse de que sea posible disponer de ella en condiciones adecuadas.
Del mismo modo que es vehículo de vida, el agua puede ser el medio por el cual se difundan enfermedades; cuando se le incorporen sustancias malignas para la salud o la vida, como ocurre cuando algunos productos de desecho son echados a las corrientes de agua sin una debida depuración previa.
 |
El agua constituye, por sus propiedades, una sustancia sumamente útil para ciertos procesos industriales, al igual que como medio de saneamiento de las ciudades y de limpieza en general.
Para muchos de esos fines, se disuelven en ella productos —como los jabones y detergentes que operan sobre otras sustancias haciéndolas también solubles en el agua, para separarlas y extraerlas. Pero eso da por resultado aguas que contienen sustancias perjudiciales, que se llaman aguas servidas, de las que es preciso deshacerse.
La disposición de las aguas servidas debe realizarse de tal manera que sea posible evitar que las sustancias perjudiciales que contienen, contaminen las fuentes de aguas puras, de las que es preciso obtener nuevamente agua en condiciones que permitan usarla sin peligro.
Para ello, es preciso que, antes de devolver esas aguas a los cauces de la naturaleza, se le separe esas sustancias perjudiciales; y a la vez ellas sean procesadas en forma de quitarles esa condición. A eso, se le llama la depuración del agua; que significa devolverle su pureza originaria.
Existen diversos métodos para depurar y purificar el agua contaminada por las actividades humanas, antes de devolverla a sus cauces naturales:
Depuración y tratamiento de las aguas
Por definición, las aguas residuales llevan elementos extraños denominados contaminantes. Por tanto, la depuración del agua consistirá en retirar de una u otra forma dichos contaminantes.
Basándose en las características y propiedades físicas de los contaminantes, se consigue su eliminación total o parcial.
Tratamientos físicos típicos:
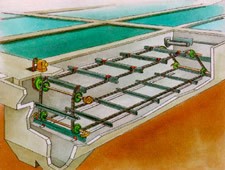 |
Sedimentación: Se basa en la separación de los contaminantes sólidos, cuya densidad es mayor que la del líquido, por acción de la gravedad.
Flotación: Se basa en la separación por diferencia de densidad de los contaminantes sólidos cuya densidad es menor que la del líquido. Esta flotación puede ser natural o provocada, como ocurre en el caso de introducción de aire a presión.
Filtración: Se fundamenta en la retención de sólidos provocada por la interposición de un medio poroso. Los sólidos quedan retenidos en la superficie o en el interior del medio poroso. Como medios porosos se utilizan materiales como arenas, carbón activo, vidrio, o membranas sintéticas. La filtración puede realizarse a presión o sin ella.
Destilación: Consiste en evaporar artificialmente el agua de forma que luego sea posible capturar el vapor para volver a condensarlo en forma líquida.
Es un método todavía más costoso, porque requiere utilizar un aparato especial llamado alambique —que puede llegar a alcanzar gran tamaño y complejidad— y disponer de un medio para calentar al agua hasta la temperatura de ebullición y eventualmente de otro sistema para volver a enfriar rápidamente el vapor para que condense. El agua purificada por destilación se llama agua destilada.
Adsorción: Por medio de la fijación (física o química) sobre un sólido el contaminante se retira de una solución. Como medios de adsorción se emplean, entre otros, carbón activo y zeolitas.
 |
Desorción (Stripping): Se provoca un stripping cuando una masa líquida se pone en contacto con una corriente de aire al cual se transfiere el contaminante. Este proceso es típico para la eliminación de amoniaco en aguas industriales con altas concentraciones del mismo.
Tratamientos químicos:
Coagulación-Floculación. Los sólidos de pequeño tamaño, mediante el uso de reactivos químicos, se agregan en sólidos mayores que son sedimentables. Normalmente son tratamientos que van seguidos de algún medio de separación física.
Mediante este tratamiento conseguimos eliminar partículas de tamaño coloidal, con velocidades de sedimentación muy bajas.
Precipitación química. Mediante este tratamiento se consigue, mediante la adición de reactivos, que contaminantes solubles se transformen en formas insolubles o de menor solubilidad.
Oxidación-Reducción química. Consiste en hacer reaccionar los contaminantes con reactivos que provoquen la pérdida de electrones (oxidación) o la ganancia de electrones (reducción) de los contaminantes.
 |
Precipitación química del agua |
Reducción electrolítica. Este tratamiento incluye reacciones de oxidación-reducción sobre la superficie de electrodos (generalmente del cátodo). Es un procedimiento de recuperación.
Intercambio iónico. Consiste en poner en contacto un líquido con un sólido que presente facilidad para intercambiar iones. Normalmente estos sólidos son resinas de intercambio iónico.
Ver: Ciclo del agua
Bibliografía
http://www.profesorenlinea.cl/Quimica/AguaCaracterisFM.htm
http://www.escueladigital.com.uy/ciencnat/agua.htm
Ver:
http://www.bonatura.com/agua.htm
http://www.lenntech.com/espanol/FAQ-quimica-agua.htm
http://www.lenntech.com/espanol/informacion-quimica-avanzada-del-agua.htm
Además, para seguir un curso gratis:
http://www.solomanuales.org/manual_quimica_basica_del_agua-manuall31126015.htm
http://www.solomanuales.org/manuales_quimica_del_agua-manuall214233.htm